1. Partikel Subatom
Pada bagian sebelumnya kamu telah mengetahui bahwa molekul air tersusun atas dua atom hidrogen (H) dan satu atom oksigen (O). Walaupun atom merupakan unit terkecil penyusun molekul, materi yang sudah sangat kecil ini ternyata tersusun atas bagian yang lebih kecil lagi yang disebut partikel subatom.
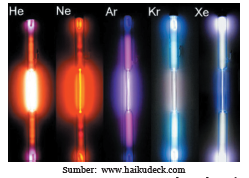
Perhatikan warna lampu pada Gambar di bawah ini Tiap-tiap lampu tersebut mengandung gas mulia, berturut-turut helium (He), neon (Ne), argon (Ar), kripton (Kr), dan xenon (Xe).
Gambar : Warna Lampu yang Berisi Gas Mulia Helium (He), Neon (Ne),
Argon (Ar), Kripton (Kr), dan Xenon (Xe)
Lampu-lampu tersebut mengeluarkan cahaya yang berwarnawarni setelah dialiri arus listrik. Gas-gas yang dilewati oleh aliran listrik tersebut berpendar sehingga menghasilkan cahaya yang berwarna-warni. Cahaya itu muncul karena adanya loncatan elektron-elektron yang terdapat di dalam atom-atom gas.
Atom tersusun atas partikel-partikel penyusun atom atau partikel subatom, yaitu neutron (n), proton (p), dan elektron (e). Neutron dan proton membentuk inti atom. Elektron menempati kulit-kulit atom yang ada di sekitar inti atom. Elektron-elektron tersebut bergerak mengelilingi inti dengan kecepatan tinggi membentuk awan elektron. Elektron dan proton merupakan partikel subatom yang mempunyai muatan berlawanan, sedangkan neutron tidak bermuatan. Elektron memiliki muatan negatif sedangkan proton memiliki muatan positif.
Gambar : Model Atom Helium (He)
Pada atom netral, jumlah proton sama dengan jumlah elektron. Tiap-tiap partikel penyusun subatom tersebut mempunyai massa. Elektron mempunyai massa sangat kecil dibandingkan dengan massa proton dan neutron. Oleh sebab itu massa atom akan terpusat pada inti atom saja atau ditentukan oleh jumlah proton dan jumlah neutronnya.
Para ilmuwan telah mempelajari atom sejak ratusan tahun lalu. Para ilmuwan tersebut mengemukakan teori-teori tentang atom. Teori yang satu akan runtuh atau ditolak ketika ada data atau fakta baru yang ditemukan tentang atom sehingga melahirkan teori atom yang baru. Berikut ini merupakan perkembangan teori atom.
Tabel. Perkembangan Teori Atom
Menurut Bohr, atom mempunyai kulit-kulit atom tempat elektron bergerak mengelilingi inti atom. Kulit atom yang paling dekat dengan inti atom mempunyai energi paling rendah. Kulit atom yang lebih jauh dari inti atom mempunyai energi yang lebih tinggi. Elektron yang berada pada kulit atom paling dalam dapat berpindah ke kulit atom yang lebih luar bila menyerap energi dari luar atom. Energi itu dapat berasal dari panas pembakaran atau dari energi listrik yang melewati atom-atom tersebut. Elektron yang terletak pada kulit atom paling luar akan mendapatkan gaya tarik yang lemah dari inti atom. Oleh karena itu elektron pada kulit atom paling luar mudah lepas dari kulit itu, sehingga atom dapat kehilangan elektron. Bila jumlah elektron dan jumlah proton dalam suatu atom tidak sama, atom tersebut akan bermuatan atau menjadi ion. Proses pembentukan ion disebut ionisasi.
2. Nomor Atom dan Nomor Massa
Unsur merupakan zat murni yang tidak dapat diubah lagi menjadi zat lain dengan reaksi kimia, seperti emas, besi, perak, oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang ditemukan di alam. Masing-masing unsur memiliki karakteristik yang berbeda-beda. Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur dan dijadikan sebagai dasar nomor atom.
Sementara nomor massa suatu atom ditentukan oleh jumlah neutron dan proton. Atom yang satu berbeda dengan atom yang lain karena mempunyai jumlah elektron, proton, dan neutron yang berbeda. Jika dua atom mempunyai massa atom berbeda, maka jari-jari kedua atom itu akan berbeda pula.
Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Setiap unsur dituliskan dengan lambang unsur. Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di kiri lambang unsur, sedangkan nomor massa ditulis sebagai superscript (naik) di kiri atas lambang unsur, sebagaimana berikut.
Sebagai contoh, penulisan lambang unsur litium (Li) yang mempunyai nomor atom 3 dan nomor massa 7 adalah .
.
Tabel Sistem Periodik
Agar kamu dapat lebih memahami penulisan lambang atom, menentukan nomor massa, jumlah proton, serta jumlah elektronnya lengkapi Tabel berikut! Kemudian kumpulkan di G-Classroom pada Tugas Pertemuan 8!
Perhatikan contoh di atas dan Tabel Periodik menentukan jumlah proton, neutron, elektron, dan nomor massa suatu atom!








Materinya mudah dipahami bu. Terima kasih
BalasHapusNama:selfi ariyanti
Kelas:9b
Absen : 26
Semoga bermanfaat
HapusMaterinya mudah dipahami.dan bermanfaat bagi saya.
BalasHapusNama : Afta Nurunnashiha
Kelas : 9B
No.absen : 02
Terima kasih bu, materinya mudah untuk dipahami.
BalasHapusNama: Silviana Nur Afiyah
Kelas: 9B
No. Absen: 27
Terimakasih Bu
BalasHapusNama Ahmad Fahrel Putra Ardian
Kelas 9A
No 03
BalasHapusNumpang promo ya Admin^^ (f)
ingin mendapatkan uang banyak dengan cara cepat
ayo segera bergabung dengan kami di ionpk.biz ^_$
add Whatshapp : +85515373217 || ditunggu ya^^ x-)
terimakasih bu,
BalasHapusNama:Desi Regita Azmi
Kelas:9E
No.absen:9